2021 年 12 月 8 日,浙江大学药学院平渊课题组在 Science Advances 期刊发表了题为:Genome-editing prodrug: Targeted delivery and conditional stabilization of CRISPR-Cas9 for precision therapy of inflammatory disease 研究论文。
该研究巧妙地结合靶向递送和前药的概念,开发出一种具有炎症靶向功能的基因编辑前药递送系统,在实现疾病治疗的同时,极大的克服了基因编辑治疗过程中的组织脱靶难题。
该递送系统通过纳米复合物表面包裹的巨噬细胞膜靶向炎症性结肠组织,微环境响应激活基因编辑工具对结肠组织细胞的 PHD2 基因位点编辑,实现结肠炎的精准治疗。

炎症性疾病多发于局部,且常表现为白细胞增多、巨噬细胞浸润、活性氧(ROS)水平高等病理特征。基于炎症病灶的特点分析,作者首先选用一种可受小分子调控活性的 Cas9 变体蛋白,其仅在小分子药物存在下,才具备基因编辑的能力;将上述的小分子进一步修饰,设计成一种具有炎症特异性激活的前药分子,使其仅在炎症环境中会被激活;使用巨噬细胞膜包裹纳米复合物,将有利于提高纳米复合物对炎症病灶的靶向能力,同时细胞膜能作为前药分子的支撑载体,最终获得了一种可在炎症环境激活基因编辑功能的仿生纳米复合物(图 1)。
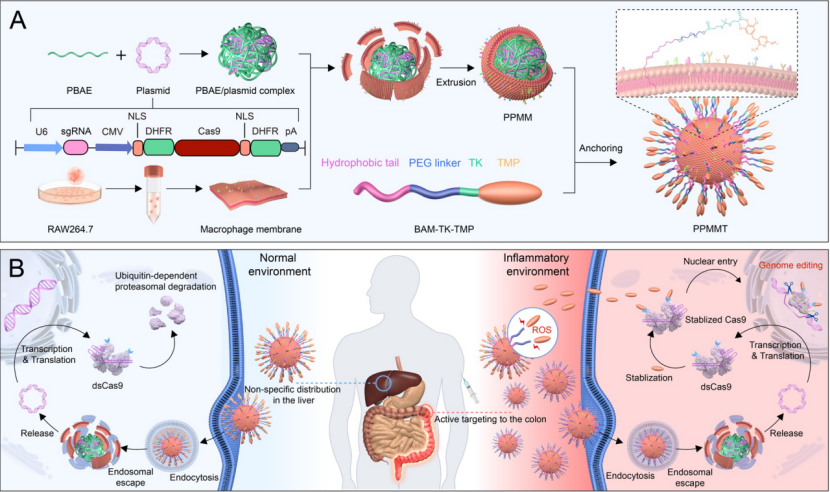
图 1. 基因编辑前药递送系统 NanoProCas9 用于炎症结肠的靶向递送和激活基因编辑的示意图
该团队对患有炎症性肠炎的小鼠进行了给药处理,并通过基因深度测序的方法,比较了 NanoProCas9 与野生型 Cas9 在组织水平的基因编辑脱靶效率。结果表明,与野生型 Cas9 相比,NanoProCas9 可以显著降低小鼠肝部、肺部、脾脏等组织的基因编辑,在结肠组织仍有较高的编辑效率(图 2),表现出更高的炎症组织特异性和安全性。
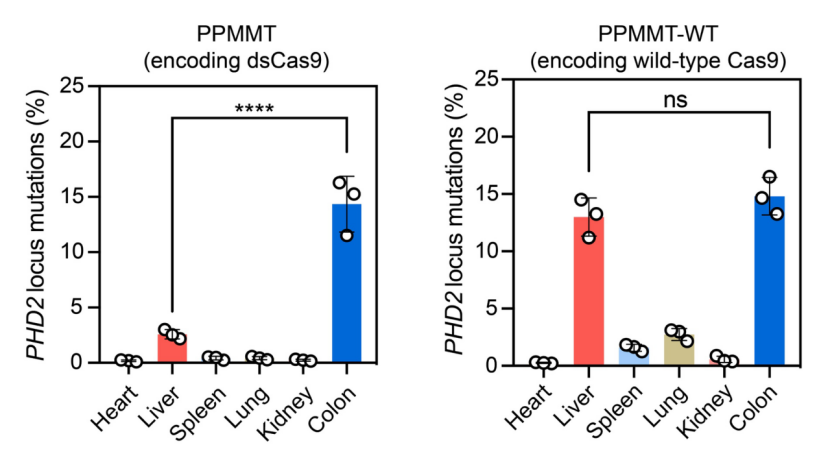
图 2. 经 NanoProCas9 或野生型 Cas9 治疗后,小鼠不同组织中的 PHD2 位点深度测序结果
结肠组织的 PHD2 蛋白表达下调,可以保护结肠组织结构完整并降低促炎因子 TNF-α 的表达。此外,纳米复合物中细胞膜上的 TNFR2 受体可以中和 TNF-α,前药分子也可中和部分的 ROS。经治疗后的小鼠结肠炎症状减轻,如结肠长度缩短、体重减轻以及疾病活动指数(DAI)增加等得到抑制(图 3)。
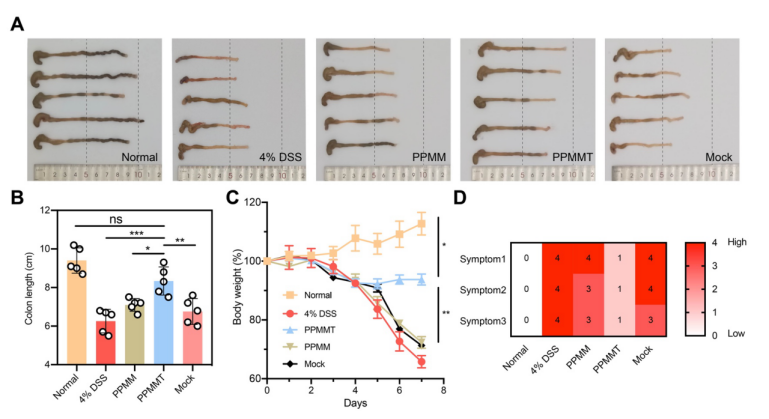
图 3. NanoProCas9 用于结肠炎疾病治疗。(A)不同处理后小鼠的结肠照片,(B)结肠长度,(C)小鼠体重以及(D)疾病活动指数
值得一提的是,该方法不仅在炎症性疾病领域表现出极大的治疗潜力,根据不同疾病的病灶生理特征,设计具有不同响应类型的前药分子 (如 GSH,ATP, pH,酶等),相信在未来这一系统将在其他疾病治疗上持续发力,提高基因编辑治疗的安全性,同时达到更好的治疗效果。
该论文第一作者为浙江大学药学院博士生颜晓杰和博士生潘齐,平渊教授为通讯作者。平渊教授团队长期致力于基因编辑工具递送载体和可调控的智能基因编辑系统的设计,如近红外光热基因编辑系统(PNAS;Adv. Mater.),微针贴片基因编辑系统(Sci. Adv. ),炎症特异性编辑系统(Sci. Adv. ),以及高效低毒的基因编辑工具递送载体(ACS Cent. Sci.;Nano Lett.; J. Control. Release; Chem. Mater. )。
论文链接:
https://www.science.org/doi/10.1126/sciadv.abj0624













